Alkohole und Phenole
Ersetzt man in einem gesättigten Kohlenwasserstoff ein H-Atom durch eine OH-Gruppe (=Hydroxygruppe), erhält man einen Alkohol, ausgehend von aromatischen Kohlenwasserstoffen kommt man zu
einem Phenol.

Spezielle Gruppen, die den Charakter einer organischen Verbindung bestimmen, bezeichnet man als funktionelle Gruppe.
Klassifizierung und Nomenklatur
Der einfachste aliphatische Alkohol ist das Methanol (CH3OH), es folgt das Ethanol (C2H5OH), das als Endprodukt der alkoholischen Gährung allgemein bekannt ist. Beim Propan gibt es zwei Möglichkeiten,
die Hydroxygruppe in der Kette unterzubringen: am Ende (n-Propanol) oder in der Mitte (Isopropanol). Diese Alkohole besitzen dieselbe Summenformel, jedoch unterschiedliche Strukturformeln, es sind Konstitutionsisomere.
Die Zahl der Isomeren erhöht sich beim Butanol


Acidität und Basizität von Alkoholen
Alkohole sind im allgemeinen leicht sauer.
Phenole sind wesentlich stärker sauer als Alkohle:
Grund: Das Phenolat-Ion ist durch Mesomerie stabilisiert (+M-Effekt)
Vergleiche mit CH3-O: hier ist die Ladung auf O fixiert.
Moleküle in denen sich die Ladung auf mehrere Atome verteilen kann, sind energieärmer als solche, in denen die Ladung an einem Atom lokalisiert sit.
Eigenschaften
Die niederen Alkohole (mit bis zu 10 C-Atomen) sind bei Raumtemperatur Flüssigkeiten, die eine geringer Dichte als Wasser aufweisen. Vergleicht man die Siedepunkte von Methanol bzw. Ethanol mit
dem eines Kohlenwasserstoffs vergleichbarer Molmasse, dann ergeben sich erhebliche Abweichungen. Methanol siedet 154°C höher als Ethanol 123°C höher als Propan. Zwischen Phenol und
Tulol beträgt die Differenz 71°C.
Die Unterschiede erklären sich aus der Tatsache, dass Alkohol- bzw. Phenol-Moleküle untereinander Wasserstoffbrücken ausbilden und sich dadurch zu höhermolekularen Assoziaten zusammenlagern,
wo wie es vom Wasser selbst bekannt ist. 
Der amphotere Charakter des Wassers gilt im Prinzip auch für Alkohole. In Gegenwart starker Säuren lagert sich ein Proton an eines der freien Elektronenpaare an. Es entsteht ein Oxonium–Ion,
der Alkohol hat als Base reagiert.

Im Phenolat–Ion ist die negative Ladung nicht nur am Sauerstoffatom lokalisiert, sondern verteilt sich auch über den Phenylrest. Man spricht davon, dass das Anion mesomeriestabilisiert
ist.

Moleküle, in denen sich die Ladung auf mehrere Atome verteilen kann, sind energieärmer als solche, in denen die Ladung an einem Atom lokalisiert ist.
Oxidation der Alkohole

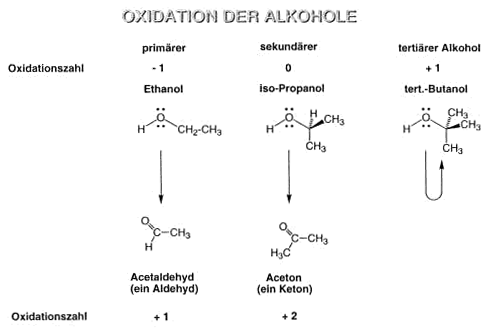
Tertiäre Alkohole können nicht oxidiert werden, da das C-Atom, das die OH-Gruppe trägt, ausserdem noch mindestens ein H-Atom tragen muss, um oxidiert zu werden.
Mehrwertige Alkohole und Phenole
In einer Kohlenwasserstoffkette kann im Prinzip jedes C-Atom eine Hydroxygruppe tragen.

pKs1: 9,12 9,15 9,91
pKs2: 12,08 (!) 11,32 12,0

Dehydrierung (Elimination von Wasser)
Eliminierung von Wasser findet bei vielen enzymatischen Reaktion stat.

Die Eliminierung von H2O ist wie die Addition von H2O regioselektiv.
Regioselektivität der Eliminierungsreaktion 
Das höher substituierte Produkt dieser Eliminierung (formal wird Wasser abgespalten) wird als Saytzev-Produkt bezeichnet. Erfolgt die Eliminierung in die andere Richtung, so spricht man von
einer Hofmann-Elominierung, bzw. von einem Hofmann-Produkt. Die bieden Elominationsprodukte sind Regioisomere, weil die Verknüpfung der Atome untereinander verschieden ist.
Da das Saytzev-Produkt energetisch ärmer ist, wird es bevorzugt.
Saytzev-Regel: Es entsteht mehr von demjenigen Alken, dessen Doppelbindung stärker substitiert ist, d.h. weniger H-Atome am Doppelbindungs-C-Atom sitzen.
Veresterung:
Allg:

|
